我校物理学院王炜教授课题组在蛋白质分子功能运动理论研究方面取得重要进展,他们的研究论文“Energy landscape views for interplay among folding, binding, and allostery of calmodulin domains”于2014年7月7日在线发表于《美国科学院院刊》(PNAS, 2014, 111, DOI:10.1073/pnas.1402768111)上,论文第一作者是李文飞教授。该项研究是与京都大学Shoji Takada教授合作,并得到国家自然科学基金和江苏省自然科学基金支持。
蛋白质分子是生命系统行使生物学功能最主要的生物大分子。在行使功能过程中,有一大类“别构蛋白”在辅助因子(如金属离子、ATP分子等)帮助下,在两个功能状态之间反复做开关运动。与只有单个功能结构的“简单蛋白”相比,这类别构蛋白序列所编码的氨基酸水平物理相互作用网络和蛋白结构展现出特殊复杂性,需同时满足如下要求: 1)具有漏斗形能量面,以保证其正确折叠;2)两个功能状态之间的能垒尽量低,以实现高效率的功能运动和别构信号的跨尺度传递;3)能够有效地结合辅助因子。别构蛋白如何协调上述三个方面要求,从而同时实现正确的折叠、高效的别构运动和精准的辅助因子结合,以及这类别构蛋白如何组装和调控下游蛋白功能运动的研究,是生物物理、生物化学、医学等多学科普遍关心的前沿方向之一。钙调蛋白(calmodulin)是典型的别构蛋白,通过与钙离子的结合,在一系列信号调控和传导过程(如细胞凋亡、肌肉收缩和神经信号传导等)中起重要作用,其研究一直是相关领域的热点课题。
最近,李文飞教授及其合作者,在统计物理学和能量面理论框架下,建立了一个能够统一描述蛋白质折叠、别构运动以及辅助因子结合的理论模型。该模型有效整合了蛋白质折叠的最小阻挫原理以及该小组前期工作中发现的蛋白质序列设计的别构特征,并基于多尺度策略描述了由辅助因子所引入的局域相互作用与蛋白质大尺度构象运动的跨尺度相互作用网络特征,以及辅助因子对能量面的重塑效应。以钙调蛋白为例,通过模拟计算,他们首次在统一的理论模型框架下实现了对别构蛋白折叠、别构运动和辅助因子结合过程的整合描述,并揭示出上述三个动力学过程相互耦合和协调运作的微观物理机制(图1)。特别是,他们发现自然界蛋白质高效率别构运动的要求会显著降低折叠能量面的优化程度,从而对折叠动力学引入阻挫。辅助因子的引入能够显著改变别构蛋白的折叠机制:在低辅助因子浓度下,别构蛋白的折叠以“自发折叠”机制为主;随着辅助因子浓度的增加,别构蛋白的折叠机制转化为“诱导折叠机制”。
以上研究结果对揭示分子层次上生物系统实现生物功能的基本物理原则和信号传导机制具有重要意义,并可为寻找基因/蛋白质缺陷相关疾病的有效治疗途径提供参考。(物理学院 秦猛 科学技术处)
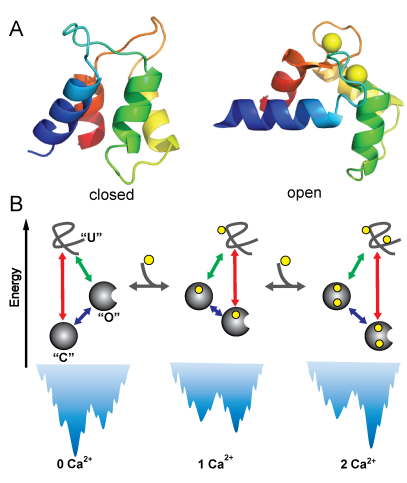
图1.(A)典型别构蛋白“钙调蛋白”(calmodulin)两个功能状态结构(左:“闭态”;右:“开态”),黄色小球表示钙离子。(B)蛋白质折叠、别构运动和辅助因子结合三个动力学过程相耦合的动力学和能量面示意图。